Este espacio es diseñado para brindar información concreta y necesaria para alumnos entre 8° y 11º grado. Además abrimos la posibilidad de recibir y responder preguntas que nos soliciten.
Puedes Ayudarme???
domingo, 17 de octubre de 2010
Mira Aquí La Canción De Los Gases!!!
Esta Canción te va a ayudar con el problemas de las leyes de los gases!!! Es Fácil de aprender!!
martes, 12 de octubre de 2010
Leyes de los Gases
La ecuación de estado que describe la relación entre presión, volumen, can tidad de gas ideal y temperatura es:
Donde:
P = Presión
V = Volumen
n = Número de moles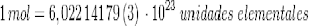
SI QUIERES VER DE FORMA DIDÁCTICA LAS LEYES DE LOS GASES, ENTRA AQUÍ!!!
http://www.youtube.com/watch?v=_P9FTI36cDI
http://www.youtube.com/watch?v=Nk8audj7R5A
PV = nRT
Donde:
P = Presión
V = Volumen
n = Número de moles
T = Temperatura
R = Constante universal de los gases
R = Constante universal de los gases
La ecuación anterior es resultado de la combinación de las expresiones derivadas de las siguientes leyes de los gases:
1. Ley de Boyle:
Relaciona el volumen y la presión cuando la temperatura y el número de moles es constante. Nos dice que el volumen de un gas es inversamente proporcional a la presión, cuando se mantienen constantes la temperatura y el número de moles.
2. Ley de Avogrado
Las constantes son la presión y temperatura, dando como resultado que el volumen sea directamente proporcional al número de moles; es decir, el volumen que ocupa un mol de cualquier gas ideal a una temperatura y presión dadas siempre es el mismo.
(V1 / n1) = (V2 / n2)
3. Ley de charles
También conocido como proceso isobárico, afirma que para una cantidad fija de gas a presión constante, el volumen que ocupa es directamente proporcional a la temperatura.
(V1 / T1) = (V2 / T2)
4. Ley de Gay – Lussac
La presión del gas, que se mantiene a volumen constante, es directamente proporcional a su temperatura; es decir, si aumentamos la temperatura, aumentará la presión y si disminuimos la temperatura disminuirá la presión.
(P1 / T1) = (P2 / T2)
SI QUIERES VER DE FORMA DIDÁCTICA LAS LEYES DE LOS GASES, ENTRA AQUÍ!!!
http://www.youtube.com/watch?v=_P9FTI36cDI
http://www.youtube.com/watch?v=Nk8audj7R5A
Suscribirse a:
Entradas (Atom)






